Картирование генов - определение положения данного гена на какой-либо хромосоме относительно других генов. Используют три основные группы методов картирования генов – физическое (определение с помощью рестрикционных карт, электронной микроскопии и некоторых вариантов электрофореза межгенных расстояний – в нуклеотидах), генетическое (определение частот рекомбинаций между генами, в частности, в семейном анализе и др.) и цитогенетическое (гибридизации in situ, получение монохромосомных клеточных гибридов, делеционный метод и др.). В генетике человека приняты 4 степени надежности локализации данного гена – подтвержденная (установлена в двух и более независимых лабораториях или на материале двух и более независимых тест - объектов), предварительная (1 лаборатория или 1 анализируемая семья), противоречивая (несовпадение данных разных исследователей), сомнительная (не уточненные окончательно данные одной лаборатории).
Генетическое картирование предполагает определение расстояний по частоте рекомбинаций между генами. Физическое картирование использует некоторые методы молекулярной генетики для определения расстояния в нуклеотидах. Генетическое картирование - это определение группы сцепления и положения картируемого гена относительно других генов данной хромосомы.
Чем больше генов известно у данного вида, тем точнее результаты этой процедуры. Как правило, число генов в группах сцепления зависит от линейных размеров соответствующих хромосом. Однако, протяженные области конститутивного гетерохроматина (в районе центромеры и теломерных участков) практически не содержат генов и, таким образом, нарушают эту зависимость.
На первом этапе картирования определяют принадлежность гена к той или иной группе сцепления. Как известно, у D. melanogaster вдиплоидном наборе четыре пары хромосом: первая пара - половые хромосомы (XX - у самок, XY - у самцов), вторая, третья и четвертая - аутосомы. Число генов в Y-хромосоме самцов очень мало. Для локализации вновь возникшей мутации необходимо располагать набором маркерных генов для каждой хромосомы. Картирование мутации основывается на анализе ее сцепления с этими маркерами. Например, если интересующая нас мутация наследуется независимо от маркеров второй хромосомы, делается вывод о ее принадлежности к другой группе сцепления.
О значении картирования генов, и в первую очередь генов человека, говорит создание Международной программы "Геном человека ", которая ставит перед собой грандиозную задачу картировать все гены человека и секвенировать полностью всю ДНК генома. Программа разрабатывается в сотнях лабораторий во многих странах мира. Используются методы молекулярной биологии, цитогенетики и генетики соматических клеток. Разработаны критерии, определяющие достоверность картирования. Определены различные уровни достоверности локализации гена.
Важным вкладом в развитие генетики стала хромосомная теория наследственности, разработанная, прежде всего, благодаря усилиям американского генетика Томаса Ханта Моргана и его учеников и сотрудников, избравших объектом своих исследований плодовую мушку Drosophila melanogaster . Изучение закономерностей сцепленного наследования позволило путем анализа результатов скрещиваний составить карты расположения генов в «группах сцепления» и сопоставить группы сцепления с хромосомами (1910-1913 гг.).
1.1. При цитологическом картировании изучение дифференциально окрашенных хромосом позволяет обнаружить крупные хромосомные перестройки путем сравнения исследуемого образца с контрольным.
1.1.1. Гибридизация in situ: ISH- и FISH- гибридизация
Прямым методом картирования генов на хромосоме является метод гибридизации нуклеиновых кислот. Вариации метода (гибридизация in situ - на месте) и FISH используются в тех случаях, когда имеются пробы, или зонды с известными (секвенированными) нуклеотидными последовательностями. Зонды - это искусственно синтезированные меченые: радиоактивными изотопами или флуоресцентными красителями - химически небольшие (10-30 нуклеогидов) сегменты одноцепочечной ДНК (или РНК), комплементарные искомому гену. Эти короткие олигонуклеотиды соединяются только с тем участком ДНК, который содержит последовательность нуклеотидов, строго соответствующую (комплементарную) последовательности нуклеотидов зонда. Следовательно, наличие связавшейся с ДНК метки с высокой точностью свидетельствует о присутствии в анализируемом образце искомых последовательностей нуклеотидов.
Локусы генов, комплементарные зондам, могут быть картированы непосредственно на хромосоме путем регистрации радиоактивной метки.
1.1.2. Хромосомный пейнтинг
Одним из наиболее разрешающих методов является многоцветная флуоресцентная гибридизация или хромосомный пейнтинг (хромосомная живопись). Для получения многоцветных изображений используют различные флуорохромы, которыми метят разные зонды ДНК. Информация об интенсивности свечения каждого флуорохрома записывается на компьютере отдельно и каждому из таких изображений присваивается свой собственный псевдоцвет.
1.1.3. Гибридизация соматических клеток
При цитологическом картировании используется также гибридизация соматических теток. В условиях культуры можно получить соматические гибриды клеток человека и различных грызунов: человек - мышь, человек - крыса, человек - хомяк. Так, к 2002 году был полностью изучен геном мыши. Оказалось, что многие гены в геноме мыши гомологичны по структуре генам человека.
1.2. Генетическое картирование
Генетические карты - это карты-схемы взаимного расположения генов на индивидуальных хромосомах, т.е. находящихся в одной группе сцепления.
Принципы генетического картирования были впервые разработаны Т. Морганом. Им же была составлена первая генетическая карта X-хромосомы дрозофилы, основанная на учете частоты образования кроссоверных и некроссоверных гамет у самок, гетерозиготных по рецессивным мутациям, локализованным в Х-хромосоме. Так. в мейозе гетерозиготных самок кроссинговер между генами у (желтое тело) и w- (белые глаза) происходил в 1,5% случаев, между генами w и m (миниатюрные крылья) -34,5%, а между генами у и т - 36% случаев.
Генетические карты сцепления правильно отражают порядок расположения генов (или генетических маркеров) на хромосомах, однако расстояния между ними имеют относительные значения, т.е. не соответствуют реальным физическим расстояниям.
1.3 . Молекулярные маркеры ДНК и их использование для генетического картирования
1.3.1. ПДРФ - маркеры ПДРФ (полиморфизм длин рестрикционных фрагментов ДНК,
Было установлено, что генетическим маркером может быть любое место в геноме, где произошло изменение в последовательности ДНК, которое обнаруживается как внутреннее различие между индивидами в популяции, но никаких внешних (фенотипических; различий между ними при этом не наблюдается.
У бактерий установлен и выделен целый ряд ферментов рестриктаз, которые узнают специфические последовательности в молекуле ДНК (обычно составляющие 4-6 нуклеотидов) и разрезают двойную спираль внутри или вблизи сайта узнавания, в результате чего образуются рестрикционные фрагменты, или рестрикты.
Отсутствие сайта узнавания может быть связано с делецией. инсер-цией или заменой нуклеотидов. Следовательно, любая мутация, изменяющая последовательность нуклеотидов сайта рестрикции, уничтожает этот сайт.
1.3.2. Молекулярные маркеры, основанные на полимера гной цепной реакции (ПЦР-маркеры)
Принципы метода ПЦР. Полимеразная цепная реакция имитирует природный процесс воспроизведения (удвоения) ДНК - репликацию, происходящую на матричной основе (по принципу комплементарности) с участием фермента ДНК-полимеразы. Но если во время репликации удваивается вся ДНК, то при ПЦР - происходит многократное копирование (воспроизведение, амплификация) лишь интересующего исследователя специфического, небольшого фрагмента, расположенного между двумя праймерами.
1.3.3. Микросателлиты и минисателлиты как молекулярные маркеры
Разновидностями сатДНК являются.микросателлиты (МКС, или простые повторяющиеся последовательности - ППП) и минисателлиты (МНС). Минимальная повторяющаяся единица (КОР) микросателлитов включает от 1 до 10 пар нуклеотидов, минисателлитов - 15 -70 пн. Их расположение в геноме и число повторений коровых единиц специфичны для каждого организма.
1.4. Физическое картирование
Физическое картирование основано на прямом анализе молекул ДНК. составляющих каждую хромосому (без анализа результатов скрещивания). Его конечная цель -определение последовательности нуклеотидов в каждой хромосоме
1.4.1. Создание рестрикционных карт
Рестрикционное картирование основано на установлении точек действия различных рестриктаз. Распределение сайтов рестрикции представляет собой своеобразный паспорт каждого фрагмента ДНК и может использоваться для его идентификации.
Банк генов. Для этого фрагменты ДНК организма присоединяют к векторным молекулам, т.е. молекулам-переносчикам чужеродных генов. В качестве векторов используют плазмиды бактерий, фаги (вирусы, инфицирующие бактерии), космиды (гибридные молекулы, полученные из ДНК фага К и бактериальной плазмиды; благодаря наличию cos-участка фага А., который обеспечивает замыкание его линейной ДНК в кольцо, космидная ДНК, включившая чужеродные гены, может быть упакована в головку бактериофага). В качестве векторов используют также искусственные хромосомы дрожжей YAK - (ЯК) и бактерий ВАС - (БАК) хромосомы.
1.4.2. Создание упорядоченных библиотек клонов. Карты контиг.
Процедура "Прогулка по хромосоме"
Чтобы установить порядок расположения клонов (т.е. клонированных фрагментов ДНК) на хромосоме (по ее длине), необходимо выявить участки их частичного перекрывания. Это можно сделать путем гибридизации нуклеиновых кислот, если известна нуклеотидная последовательность хотя бы одного фрагмента. Его метят радиоактивно или флуорохромом и используют в качестве зонда для создания упорядоченных библиотек клонов.
"Прогулка по хромосоме" (скользящее зондирование). Для упорядочивания клонов используют две разные библиотеки геномной ДНК, полученные из ДНК одного и того же организма, но разделенные двумя разными рестриктазами. Если один из генов (или клонов) в первой библиотеке удалось картировать и клонировать (т.е. получить из него ДНК-маркирующий сайт - STS), он затем может быть использован в качестве зонда для выявления перекрывающегося клона во второй библиотеке. А изученный клон второй библиотеки может использоваться как зонд для другого перекрывающегося фрагмента первой библиотеки и т.д.
Таким образом устанавливается порядок расположения клонов на хромосоме.
1.4. Определение нуклеотидной последовательности генома (секвенирование ) Исчерпывающая физическая карта генома человека (и любого другого организма) должна представлять собой полную последовательность нуклеотидов ДНК всех его хромосом.
1.5. Кандидатное картирование
В рамках этих подходов картировать ген означало пройти путь от его функции к локализации на хромосоме (позиции).
Независимо от того, наследуется ли болезнь по одному из менделирующих типов или просто чаще встречается у родственников больных, генетический вклад в болезнь состоит из генотипических различий среди членов семьи или вызывающих болезнь, или изменяющих в ту или другую сторону восприимчивость к болезни.
Геномика , завершив исследование последовательности ДНК человека в ходе реализации проекта « », обеспечила генетиков полным списком всех генов человека, знаниями об их положении и структуре и каталогом нескольких миллионов вариантов последовательностей ДНК, обнаруженных в разных популяциях. Некоторые из этих вариантов весьма частые, другие редкие, остальные различаются по частоте в разных этнических группах.
Некоторые варианты имеют явные функциональные последствия , другие - несомненно, нейтральны. Для большинства значение для человеческого здоровья неизвестно.
Мы также очертили роль отбора и дрейфа генов , влияющих на частоту различных аллелей в популяции. В статьях на нашем сайте МедУнивер мы обсудим, как процесс мейоза, действуя во времени и в пространстве, определяет связь между генами и полиморфными локусами с их окружением.
Сначала мы представим, какую информацию о «генетическом пейзаже » генома человека дали исследования наследования генетических вариантов, а затем опишем два фундаментальных метода идентификации генов болезни. Первый метод, анализ сцепления, основан на обследовании семей.
Анализ сцепления имеет явные преимущества перед семейными родословными для определения наследования болезни в нескольких поколениях, позволяя обнаружить последовательную постоянную передачу конкретного региона генома всякий раз, когда болезнь передается в семье. Второй метод, анализ ассоциаций, основан на обследовании популяций. Анализ ассоциаций прямо не зависит от родословных, но исследует повышение или снижение частоты конкретного аллеля ил» набора аллелей в выборке больных, взятой из популяции, по сравнению с контрольной группой здоровых людей.
Анализ ассоциаций имеет преимущество перед анализом всей популяции для поиска аллелей, более или менее часто обнаруживаемых у больных по сравнению со здоровой контрольной группой.
Исследования сцепления и ассоциации для идентификации генов болезней оказало огромное влияние на понимание патогенеза и патофизиологии многих болезней. Эти знания также позволили предложить новые методы профилактики, лечения и контроля.
Как картирование генов помогает медицинской генетике?
Картирование генов болезней имеет непосредственное клиническое применение, обеспечивая информацию о позиции гена, используемую для разработки методов косвенного анализа сцепления в пренатальной и пресимптоматической диагностике и выявлении носительства.
Картирование генов болезни критически важно для начального поиска гена болезни. Картирование фокусирует внимание на ограниченном регионе генома для выполнения систематизации всех имеющихся в нем генов, так что мы можем найти мутации или варианты, которые содействуют болезни (позиционное клонирование).
Позиционное клонирование гена болезни обеспечивает возможность охарактеризовать заболевание по степени локусной гетерогенности, спектру аллельной гетерогенности, частоте различных патогенных или предрасполагающих к болезни вариантов в различных популяциях, пенетрантности и ожидаемой частоте мутаций, доле общего генетического вклада в болезнь, соотнесенных с вариантами в разных локусах и природе болезни у бессимптомных пациентов группы риска.
Описание генов и мутаций
улучшает понимание патогенеза заболеваний и способствует развитию таких направлений, как:
- чувствительная специфическая диагностика прямым обнаружением мутации;
- популяционный скрининг на носительство для выявления групп риска по болезни у обследуемых или их потомства;
- клеточные и животные модели;
- лекарственная терапия для профилактики и лечения болезни или замедления ее протекания;
- лечение заменой гена.
Алфред Стёртевант (сотрудник Моргана) предположил, что частота кроссинговера на участке между генами, локализованными в одной хромосоме, может служить мерой расстояния между генами. Иными словами, частота кроссинговера, выражаемая отношением числа кроссоверных особей к общему числу особей, прямо пропорциональная расстоянию между генами. Тогда можно использовать частоту кроссинговера для того, чтобы определять взаимное расположение генов и расстояние между генами.
Генетическое картирование – это определение положения какого-либо гена по отношению к двум (как минимум) другим генам. Постоянство процента кроссинговера между определенными генами позволяет локализовать их. Единицей расстояния между генами служит 1 % кроссинговера; в честь Моргана эта единица называется морганида (М), или сантиморганида (сМ).
На первом этапе картирования необходимо определить принадлежность гена к группе сцепления. Чем больше генов известно у данного вида, тем точнее результаты картирования. Все гены разбивают на группы сцепления.
Число групп сцепления соответствует гаплоидному набору хромосом. Например, у D. melanogaster 4 группы сцепления, у кукурузы – 10, у мыши – 20, у человека – 23 группы сцепления. При наличии половых хромосом они указываются дополнительно (например, у человека 23 группы сцепления плюс Y-хромосома).
Как правило, число генов в группах сцепления зависит от линейных размеров соответствующих хромосом. Так, у плодовой мушки имеется одна (IV) точечная (при анализе в световом микроскопе) хромосома. Соответственно число генов в ней во много раз меньше, чем в остальных, значительно превосходящих ее по длине. Следует также отметить, что в гетерохроматических районах хромосом генов нет или почти нет, поэтому протяженные области конститутивного гетерохроматина могут несколько изменить пропорциональность числа генов и длины хромосомы.
На основании генетического картирования составляются генетические карты. На генетических картах крайнему гену (т.е. наиболее удаленному от центромеры) соответствует нулевая (исходная) точка. Удаленность какого-либо гена от нулевой точки обозначается в морганидах.
Если хромосомы достаточно длинные, то удаление гена от нулевой точки может превышать 50 М – тогда возникает противоречие между отмеченными на карте расстояниями, превышающими 50%, и постулированным выше положением, согласно которому 50 % кроссоверов, полученных в эксперименте, фактически должны означать отсутствие сцепления, т. e. локализацию генов в разных хромосомах. Это противоречие объясняется тем, что при составлении генетических карт суммируются расстояния между двумя наиболее близкими генами, что превышает экспериментально наблюдаемый процент кроссинговера.
 Генетические и физические карты По общепринятой классификации методы картирования геномов подразделяют на две категории: p Генетическое картирование p Физическое картирование 2
Генетические и физические карты По общепринятой классификации методы картирования геномов подразделяют на две категории: p Генетическое картирование p Физическое картирование 2
 Составление генетических карт p p Маркёры – позиции каких-либо отличительных признаков. В качестве маркёров на протяжении десятилетий использовались гены, определяющие легко различимые фенотипы. Для более сложных карт использовались в качестве фенотипических признаков организма его биохимические особенности. Карта, основанная на генах, не может быть очень подробной. Также только часть всего числа генов существует в удобно различимых аллельных формах. 3
Составление генетических карт p p Маркёры – позиции каких-либо отличительных признаков. В качестве маркёров на протяжении десятилетий использовались гены, определяющие легко различимые фенотипы. Для более сложных карт использовались в качестве фенотипических признаков организма его биохимические особенности. Карта, основанная на генах, не может быть очень подробной. Также только часть всего числа генов существует в удобно различимых аллельных формах. 3
 ДНК-маркёры ДНК–маркёры – нанесённые на карту особенности, которые не являются генами. Всякий пригодный ДНК–маркёр должен иметь два аллеля, как и ген–маркёр. Этому требованию удовлетворяют три типа особенностей последовательности ДНК: -Полиморфизмы длины фрагментов рестрикции (RFLP); -Полиморфизмы длины простых последовательностей (SSLP); -Полиморфизмы отдельных нуклеотидов (SNP). 4
ДНК-маркёры ДНК–маркёры – нанесённые на карту особенности, которые не являются генами. Всякий пригодный ДНК–маркёр должен иметь два аллеля, как и ген–маркёр. Этому требованию удовлетворяют три типа особенностей последовательности ДНК: -Полиморфизмы длины фрагментов рестрикции (RFLP); -Полиморфизмы длины простых последовательностей (SSLP); -Полиморфизмы отдельных нуклеотидов (SNP). 4
 1 ДНК-маркёр. Полиморфизмы длины рестриктов RFLP – первый тип ДНК-маркёров, который был полностью изучен. Ферменты рестрикции разрезают ДНК в определённых сайтах узнавания. Эта специфичность означает, что обработка молекулы ДНК ферментом рестрикции должна производить один и тот же набор фрагментов. С молекулами геномной ДНК так происходит не всегда, так как некоторые участки рестрикции полиморфны и существуют в виде двух аллелей: один показывает правильную последовательность для участка рестрикции и потому разрезается ферментом при обработке ДНК, а второй аллель несёт видоизменение последовательности, так что участок рестрикции уже не опознаётся. В результате этого два смежных фрагмента 5 рестрикции остаются связанными вместе, что
1 ДНК-маркёр. Полиморфизмы длины рестриктов RFLP – первый тип ДНК-маркёров, который был полностью изучен. Ферменты рестрикции разрезают ДНК в определённых сайтах узнавания. Эта специфичность означает, что обработка молекулы ДНК ферментом рестрикции должна производить один и тот же набор фрагментов. С молекулами геномной ДНК так происходит не всегда, так как некоторые участки рестрикции полиморфны и существуют в виде двух аллелей: один показывает правильную последовательность для участка рестрикции и потому разрезается ферментом при обработке ДНК, а второй аллель несёт видоизменение последовательности, так что участок рестрикции уже не опознаётся. В результате этого два смежных фрагмента 5 рестрикции остаются связанными вместе, что


 Визуализация RFLP 2. ПЦР используется гораздо чаще. Затравки для ПЦР разрабатываются таким образом, чтобы они отжигались к обеим сторонам полиморфного участка, и RFLP типизируется путём обработки размноженного фрагмента ферментом рестрикции и последующего пробега образца в агарозном геле. 8
Визуализация RFLP 2. ПЦР используется гораздо чаще. Затравки для ПЦР разрабатываются таким образом, чтобы они отжигались к обеим сторонам полиморфного участка, и RFLP типизируется путём обработки размноженного фрагмента ферментом рестрикции и последующего пробега образца в агарозном геле. 8
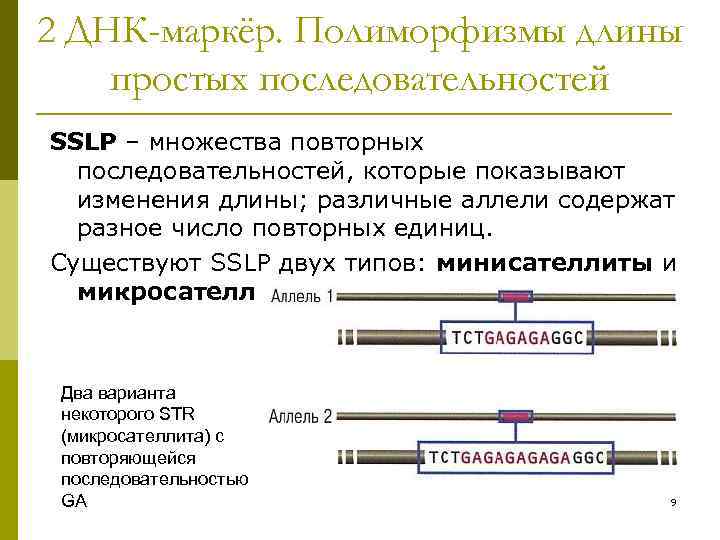 2 ДНК-маркёр. Полиморфизмы длины простых последовательностей SSLP – множества повторных последовательностей, которые показывают изменения длины; различные аллели содержат разное число повторных единиц. Существуют SSLP двух типов: минисателлиты и микросателлиты. Два варианта некоторого STR (микросателлита) с повторяющейся последовательностью GA 9
2 ДНК-маркёр. Полиморфизмы длины простых последовательностей SSLP – множества повторных последовательностей, которые показывают изменения длины; различные аллели содержат разное число повторных единиц. Существуют SSLP двух типов: минисателлиты и микросателлиты. Два варианта некоторого STR (микросателлита) с повторяющейся последовательностью GA 9
 Типы SSLP Минисателлиты (переменное число тандемных повторений, или VNTR). Повторная единица может иметь длину до 25 п. н. 2. Микросателлиты (простые тандемные повторения, или STR). Повторяющийся элемент – 13 п. н. или меньше. 1. 10
Типы SSLP Минисателлиты (переменное число тандемных повторений, или VNTR). Повторная единица может иметь длину до 25 п. н. 2. Микросателлиты (простые тандемные повторения, или STR). Повторяющийся элемент – 13 п. н. или меньше. 1. 10
 Типы SSLP ДНК-маркёры, основанные на микросателлитах, более популярны, чем основанные на минисателлитах, по двум причинам: -Минисателлиты неравномерно распределены по всему геному, чаще встречаются в теломерных областях на концах хромосом, микросателлиты более равномерно распределены в геноме. -точная типизация полиморфизма длины путём ПЦР возможна при длине последовательностей не более 300 п. н. , а большинство минисателлитных аллелей 11
Типы SSLP ДНК-маркёры, основанные на микросателлитах, более популярны, чем основанные на минисателлитах, по двум причинам: -Минисателлиты неравномерно распределены по всему геному, чаще встречаются в теломерных областях на концах хромосом, микросателлиты более равномерно распределены в геноме. -точная типизация полиморфизма длины путём ПЦР возможна при длине последовательностей не более 300 п. н. , а большинство минисателлитных аллелей 11
 3 ДНК- маркёр. Полиморфизмы отдельных нуклеотидов SNP – это позиции генома, в которых некоторые индивидуумы имеют один нуклеотид, например, G, а другие имеют отличающийся от него нуклеотид – С. 12
3 ДНК- маркёр. Полиморфизмы отдельных нуклеотидов SNP – это позиции генома, в которых некоторые индивидуумы имеют один нуклеотид, например, G, а другие имеют отличающийся от него нуклеотид – С. 12
 Большинство SNP имеют 2 аллеля, поскольку SNP возникают, когда в геноме происходят точечные мутации, преобразовывающие один нуклеотид в другой. Если подобная мутация случится в репродуктивных клетках, то один или более его потомков могут унаследовать эту мутацию, и в итоге SNP станет закреплённым в популяции. 13
Большинство SNP имеют 2 аллеля, поскольку SNP возникают, когда в геноме происходят точечные мутации, преобразовывающие один нуклеотид в другой. Если подобная мутация случится в репродуктивных клетках, то один или более его потомков могут унаследовать эту мутацию, и в итоге SNP станет закреплённым в популяции. 13
 Методы типизации SNP Методы базируются на анализе гибридизацией олигонуклеотидов. -Технология чипов ДНК - Методы гибридизации в растворе - Анализ лигированием олигонуклеотидов (OLA) - Система размножения термостабильных мутаций, или тест ARMS. 14
Методы типизации SNP Методы базируются на анализе гибридизацией олигонуклеотидов. -Технология чипов ДНК - Методы гибридизации в растворе - Анализ лигированием олигонуклеотидов (OLA) - Система размножения термостабильных мутаций, или тест ARMS. 14
 Методы типизации SNP Технология чипов ДНК На поверхность стеклянной пластины площадью 2 см 2 с множеством различных олигонуклеотидов пипеткой наносится предназначенная для тестирования ДНК, помеченная флюоресцентным маркёром. Гибридизация детектируется путём анализа чипа с помощью флюоресцентного микроскопа. Позиции, в которых испускается флюоресцентный сигнал, показывают, какие олигонуклеотиды 1. 15
Методы типизации SNP Технология чипов ДНК На поверхность стеклянной пластины площадью 2 см 2 с множеством различных олигонуклеотидов пипеткой наносится предназначенная для тестирования ДНК, помеченная флюоресцентным маркёром. Гибридизация детектируется путём анализа чипа с помощью флюоресцентного микроскопа. Позиции, в которых испускается флюоресцентный сигнал, показывают, какие олигонуклеотиды 1. 15
 Методы типизации SNP 2. Метод гибридизации в растворе Используется пара меток, в которые входит флюоресцентный краситель и вещество, гасящее флюоресцентный сигнал при сближении с испускающим его красителем. Краситель прикрепляется к одному концу олигонуклеотида, гасящее вещество – к другому концу. Если между олигонуклеотидом и тестируемой ДНК происходит гибридизация, то данное спаривание оснований нарушается, гаситель отрывается от красителя, и тот вырабатывает флюоресцентный сигнал. 16
Методы типизации SNP 2. Метод гибридизации в растворе Используется пара меток, в которые входит флюоресцентный краситель и вещество, гасящее флюоресцентный сигнал при сближении с испускающим его красителем. Краситель прикрепляется к одному концу олигонуклеотида, гасящее вещество – к другому концу. Если между олигонуклеотидом и тестируемой ДНК происходит гибридизация, то данное спаривание оснований нарушается, гаситель отрывается от красителя, и тот вырабатывает флюоресцентный сигнал. 16
 Методы типизации SNP 3. Анализ лигированием нуклеотидов (OLA) Применяются два олигонуклеотида, которые отжигаются смежно другу, при этом 3’-конец одного из них точно попадает в SNP. Этот олигонуклеотид образует полностью спаренную основаниями структуру, если в матричной ДНК присутствует одна версия SNP, и когда это происходит, данный олигонуклеотид может быть 17
Методы типизации SNP 3. Анализ лигированием нуклеотидов (OLA) Применяются два олигонуклеотида, которые отжигаются смежно другу, при этом 3’-конец одного из них точно попадает в SNP. Этот олигонуклеотид образует полностью спаренную основаниями структуру, если в матричной ДНК присутствует одна версия SNP, и когда это происходит, данный олигонуклеотид может быть 17
 Методы типизации SNP 4. Система размножения термостабильных мутаций (тест ARMS) Контрольным олигонуклеотидом выступает одна из пары затравок ПЦР. Если контрольная затравка отжигается к SNP, то он может быть продолжен с помощью полимеразы Taq и ПЦР может иметь место, но если она не отжигается из-за того, что присутствует альтернативная версия SNP, то никаких продуктов ПЦР не 18
Методы типизации SNP 4. Система размножения термостабильных мутаций (тест ARMS) Контрольным олигонуклеотидом выступает одна из пары затравок ПЦР. Если контрольная затравка отжигается к SNP, то он может быть продолжен с помощью полимеразы Taq и ПЦР может иметь место, но если она не отжигается из-за того, что присутствует альтернативная версия SNP, то никаких продуктов ПЦР не 18
 Сцепление генетических признаков Генетическое картирование основано на законах наследственности, описанных Грегором Менделем ещё в 1865 году. Помимо первых двух законов Менделя, встречаются ещё два случая необычного сцепления: -Неполное доминирование (гетерозиготная форма проявляет фенотип, промежуточный между двумя гомозиготными формами); -Кодоминирование (гетерозиготная форма показывает оба гомозиготных фенотипа) 19
Сцепление генетических признаков Генетическое картирование основано на законах наследственности, описанных Грегором Менделем ещё в 1865 году. Помимо первых двух законов Менделя, встречаются ещё два случая необычного сцепления: -Неполное доминирование (гетерозиготная форма проявляет фенотип, промежуточный между двумя гомозиготными формами); -Кодоминирование (гетерозиготная форма показывает оба гомозиготных фенотипа) 19
 Определяющий шаг в развитии генетического картирования Когда в 1900 году законы Менделя были переоткрыты, выяснилось, что полное сцепление, которое ожидалось между многими парами генов, не осуществилось. Пары генов или наследовались независимо, или показывали лишь неполное сцепление: иногда наследовались вместе, иногда порознь. p Разрешение этого противоречия и стало решающим шагом в развитии составления генетических карт. p 20
Определяющий шаг в развитии генетического картирования Когда в 1900 году законы Менделя были переоткрыты, выяснилось, что полное сцепление, которое ожидалось между многими парами генов, не осуществилось. Пары генов или наследовались независимо, или показывали лишь неполное сцепление: иногда наследовались вместе, иногда порознь. p Разрешение этого противоречия и стало решающим шагом в развитии составления генетических карт. p 20
 Рассуждения Томаса Моргана Неполное сцепление объясняется поведением хромосом во время мейоза. p Процесс кроссинговера (или рекомбинации) был открыт бельгийским цитологом Янсеном в 1909 году и помог Моргану объяснить неполное сцепление. Рассмотрим эффект, который имеет кроссинговер на наследование генов. p 21
Рассуждения Томаса Моргана Неполное сцепление объясняется поведением хромосом во время мейоза. p Процесс кроссинговера (или рекомбинации) был открыт бельгийским цитологом Янсеном в 1909 году и помог Моргану объяснить неполное сцепление. Рассмотрим эффект, который имеет кроссинговер на наследование генов. p 21
 Эффект кроссинговера Имеется два возможных сценария: p Между генами А и В не происходит кроссинговер. Тогда две гаметы имеют генотип АВ, две другие – аb. p Между генами А и В происходит кроссинговер. Это приводит к обмену сегментами ДНК между гомологичными хромосомами. В итоге каждая гамета имеет отличный от других генотип: AB, a. B, Ab и ab. Помимо гамет с родительскими генотипами появляются гаметы с 22
Эффект кроссинговера Имеется два возможных сценария: p Между генами А и В не происходит кроссинговер. Тогда две гаметы имеют генотип АВ, две другие – аb. p Между генами А и В происходит кроссинговер. Это приводит к обмену сегментами ДНК между гомологичными хромосомами. В итоге каждая гамета имеет отличный от других генотип: AB, a. B, Ab и ab. Помимо гамет с родительскими генотипами появляются гаметы с 22
 Составление генетических карт Когда Морган объяснил неполное сцепление кроссинговером, он изобрёл способ наносить на карту отдельные позиции генов в хромосоме. Допустим, кроссинговер является случайным событием, а значит, может произойти в любой позиции на протяжении пары вытянутых одна вдоль другой хроматид. Если это верно, то два гена, расположенные близко друг к другу, будут разделяться кроссинговерами реже, чем гены, лежащие дальше друг от друга. Частота, с которой гены разъединяются кроссинговерами, будет прямо пропорциональна отдалению их друг от друга. Поэтому частота рекомбинации является мерой расстояния 23
Составление генетических карт Когда Морган объяснил неполное сцепление кроссинговером, он изобрёл способ наносить на карту отдельные позиции генов в хромосоме. Допустим, кроссинговер является случайным событием, а значит, может произойти в любой позиции на протяжении пары вытянутых одна вдоль другой хроматид. Если это верно, то два гена, расположенные близко друг к другу, будут разделяться кроссинговерами реже, чем гены, лежащие дальше друг от друга. Частота, с которой гены разъединяются кроссинговерами, будет прямо пропорциональна отдалению их друг от друга. Поэтому частота рекомбинации является мерой расстояния 23
 Анализ сцепления генетических признаков у организмов различного типа. Включает три ситуации: p Анализ сцепления генетических признаков у видов наподобие плодовой мушки и мыши, с которыми можно выполнять эксперименты по скрещиванию; p Анализ сцепления генетических признаков у людей, с которыми нельзя проводить эксперименты, но можно изучать родословные; p Анализ сцепления генетических признаков у бактерий, которые не 24
Анализ сцепления генетических признаков у организмов различного типа. Включает три ситуации: p Анализ сцепления генетических признаков у видов наподобие плодовой мушки и мыши, с которыми можно выполнять эксперименты по скрещиванию; p Анализ сцепления генетических признаков у людей, с которыми нельзя проводить эксперименты, но можно изучать родословные; p Анализ сцепления генетических признаков у бактерий, которые не 24
 Анализ сцепления генетических признаков при возможности проведения скрещивания Метод основан на анализе потомства от экспериментальных скрещиваний, при известных генотипах родителей. Обычно используется анализирующее скрещивание. Этот метод применим ко всем эукариотам, но неприменим к человеку из этических соображений. 25
Анализ сцепления генетических признаков при возможности проведения скрещивания Метод основан на анализе потомства от экспериментальных скрещиваний, при известных генотипах родителей. Обычно используется анализирующее скрещивание. Этот метод применим ко всем эукариотам, но неприменим к человеку из этических соображений. 25
 Составление генетической карты на основе анализа родословной человека Зачастую из-за соблюдения научной и медицинской этики учёные могут оперировать лишь скудными данными, так как браки редко дают удобное анализирующее скрещивание, и генотипы многих членов семей могут быть неизвестны ввиду смерти или нежелания сотрудничать. Обыкновенно, чтобы решить необходимую генетическую задачу, достаточно знать дополнительно генотип хотя бы одного родственника, но по разным причинам это невозможно. 26
Составление генетической карты на основе анализа родословной человека Зачастую из-за соблюдения научной и медицинской этики учёные могут оперировать лишь скудными данными, так как браки редко дают удобное анализирующее скрещивание, и генотипы многих членов семей могут быть неизвестны ввиду смерти или нежелания сотрудничать. Обыкновенно, чтобы решить необходимую генетическую задачу, достаточно знать дополнительно генотип хотя бы одного родственника, но по разным причинам это невозможно. 26
 Составление генетических карт бактерий Главная трудность состоит в том, что бактерии гаплоидны и не подвергаются мейозу. Поэтому используются три способа, способные вызвать кроссинговер: p В процессе коньюгации происходит передача эписомы (сегмент хромосомной ДНК длиной до 1 млн. п. н.) p Трансдукция (передача фрагмента ДНК длиной до 50 тыс. п. н. через бактериофаг) p Трансформация (клетка-реципиент 27
Составление генетических карт бактерий Главная трудность состоит в том, что бактерии гаплоидны и не подвергаются мейозу. Поэтому используются три способа, способные вызвать кроссинговер: p В процессе коньюгации происходит передача эписомы (сегмент хромосомной ДНК длиной до 1 млн. п. н.) p Трансдукция (передача фрагмента ДНК длиной до 50 тыс. п. н. через бактериофаг) p Трансформация (клетка-реципиент 27
 Составление физических карт Полученная исключительно генетическими методами карта не будет полностью точна. Это обусловлено следующими причинами: 1. Разрешение генетической карты зависит от числа кроссинговеров, которые были набраны. Для микроорганизмов это не главная проблема, поскольку они могут быть получены в любом количестве. Проблема с людьми и другими эукариотами в том, что невозможно получить большое число потомков, так как может быть изучено сравнительно 28
Составление физических карт Полученная исключительно генетическими методами карта не будет полностью точна. Это обусловлено следующими причинами: 1. Разрешение генетической карты зависит от числа кроссинговеров, которые были набраны. Для микроорганизмов это не главная проблема, поскольку они могут быть получены в любом количестве. Проблема с людьми и другими эукариотами в том, что невозможно получить большое число потомков, так как может быть изучено сравнительно 28
 Составление физических карт 2. Генетические карты имеют ограниченную точность. На картинке изображено сравнение физической и генетической карт дрожжей Saccharomyces cerevisiae. Сравнение показывает, что порядок двух верхних маркёров на генетической карте неверен и также есть различия в относительном 29
Составление физических карт 2. Генетические карты имеют ограниченную точность. На картинке изображено сравнение физической и генетической карт дрожжей Saccharomyces cerevisiae. Сравнение показывает, что порядок двух верхних маркёров на генетической карте неверен и также есть различия в относительном 29

 Составление рестрикционных карт Простейший способ составления рестрикционной карты – сравнение размеров фрагментов, полученных при переваривании молекулы ДНК двумя разными ферментами рестрикции. Выбрать единственно верную карту позволяет дополнительная обработка исходной ДНК одним ферментом с предотвращением протекания переваривания до конца. Это называется частичной рестрикцией. Масштаб рестрикционной карты ограничивается длиной рестриктов. Рестрикционное картирование более приемлемо для маленьких молекул. 31
Составление рестрикционных карт Простейший способ составления рестрикционной карты – сравнение размеров фрагментов, полученных при переваривании молекулы ДНК двумя разными ферментами рестрикции. Выбрать единственно верную карту позволяет дополнительная обработка исходной ДНК одним ферментом с предотвращением протекания переваривания до конца. Это называется частичной рестрикцией. Масштаб рестрикционной карты ограничивается длиной рестриктов. Рестрикционное картирование более приемлемо для маленьких молекул. 31
 Составление рестрикционных карт Возможно ли использование рестрикционного анализа для картирования геномов размером более 50 тыс. п. н. ? Да, ограничения рестрикционного картирования могут быть ослаблены за счёт подбора ферментов, которые имеют редкие участки разрезания в целевой молекуле ДНК («редкощепящие рестриктазы») 32
Составление рестрикционных карт Возможно ли использование рестрикционного анализа для картирования геномов размером более 50 тыс. п. н. ? Да, ограничения рестрикционного картирования могут быть ослаблены за счёт подбора ферментов, которые имеют редкие участки разрезания в целевой молекуле ДНК («редкощепящие рестриктазы») 32
 Метод OFAGE Электрофорез в геле с ортогонально чередующимся полем. Таким образом, каждое изменение поля вынуждает молекулы перестраиваться, короткие молекулы перестраиваются и Электрическое поле чередуется мигрируют через гель между двумя парами быстрее длинных. За счёт электродов, каждая из которых такого приёма позволяются помещена по углом 45° к более длинные фрагменты, продольной линии геля. чем при обычном электрофорезе. К подобного рода методам относят также CHEF – электрофорез в геле с однородными электрическими полями и 33 FIGE – электрофорез в геле с обращением поля.
Метод OFAGE Электрофорез в геле с ортогонально чередующимся полем. Таким образом, каждое изменение поля вынуждает молекулы перестраиваться, короткие молекулы перестраиваются и Электрическое поле чередуется мигрируют через гель между двумя парами быстрее длинных. За счёт электродов, каждая из которых такого приёма позволяются помещена по углом 45° к более длинные фрагменты, продольной линии геля. чем при обычном электрофорезе. К подобного рода методам относят также CHEF – электрофорез в геле с однородными электрическими полями и 33 FIGE – электрофорез в геле с обращением поля.
 Непосредственное наблюдение участков рестрикции в молекулах ДНК. Для нанесения на карту участков рестрикции можно использовать методы, не связанные с электрофорезом. p Метод оптического картирования: позиции участков рестрикции определяются путём непосредственного наблюдения разрезанных молекул ДНК в микроскоп. Для закрепления ДНК на предметном стекле используют вытягивание гелем и расчёсывание молекул. p Для вытягивания гелем хромосомную ДНК переводят во взвесь в расплавленной агарозе и помещают на предметное стекло микроскопа. По мере охлаждения и затвердевания геля молекулы ДНК вытягиваются. p Для расчёсывания волокна ДНК приготовляют путём погружения покрытого силиконом покровного стекла в раствор ДНК, выдерживая его там в течение 5 минут. Далее вынимают стекло из раствора. Сила, необходимая для 34 протягивания ДНК через поверхностный мениск, заставляет каждую из них вытягиваться в линию. При засыхании ДНК
Непосредственное наблюдение участков рестрикции в молекулах ДНК. Для нанесения на карту участков рестрикции можно использовать методы, не связанные с электрофорезом. p Метод оптического картирования: позиции участков рестрикции определяются путём непосредственного наблюдения разрезанных молекул ДНК в микроскоп. Для закрепления ДНК на предметном стекле используют вытягивание гелем и расчёсывание молекул. p Для вытягивания гелем хромосомную ДНК переводят во взвесь в расплавленной агарозе и помещают на предметное стекло микроскопа. По мере охлаждения и затвердевания геля молекулы ДНК вытягиваются. p Для расчёсывания волокна ДНК приготовляют путём погружения покрытого силиконом покровного стекла в раствор ДНК, выдерживая его там в течение 5 минут. Далее вынимают стекло из раствора. Сила, необходимая для 34 протягивания ДНК через поверхностный мениск, заставляет каждую из них вытягиваться в линию. При засыхании ДНК

 Флюоресцентная гибридизация in situ (FISH) В этой методике маркёром является последовательность ДНК, которая отображается путём гибридизации с флюоресцентным зондом. Ненарушенная хромосома исследуется путём её зондирования меченой молекулой ДНК. Для работы метода ДНК в хромосоме денатурируется(высушивается на предметном стекле и обрабатывается 36
Флюоресцентная гибридизация in situ (FISH) В этой методике маркёром является последовательность ДНК, которая отображается путём гибридизации с флюоресцентным зондом. Ненарушенная хромосома исследуется путём её зондирования меченой молекулой ДНК. Для работы метода ДНК в хромосоме денатурируется(высушивается на предметном стекле и обрабатывается 36
 FISH в действии 1. 2. Первоначально метод использовался с метафазными хромосомами, но их сильная уплотнённость не позволяла составлять карты с высокой разрешающей способностью. В 1995 году был разработан ряд методов FISH более высокого разрешения. Оно достигалось за счёт изменения характера изучаемого хромосомного аппарата. Если метафазные хромосомы слишком сжаты для крупномасштабного картирования, то нам следует использовать хромосомы в более вытянутом виде. Добиться этого можно двумя способами. Механически вытянутые хромосомы могут быть получены за счёт изменения метода приготовления препарата, применяемого для выделения хромосом из метафазных ядер. Неметафазные хромосомы используются, потому что во всех стадиях клеточного цикла, кроме метафазы, хромосомы пребывают в естественном для них 37 развёрнутом состоянии. Интерфазные хромосомы
FISH в действии 1. 2. Первоначально метод использовался с метафазными хромосомами, но их сильная уплотнённость не позволяла составлять карты с высокой разрешающей способностью. В 1995 году был разработан ряд методов FISH более высокого разрешения. Оно достигалось за счёт изменения характера изучаемого хромосомного аппарата. Если метафазные хромосомы слишком сжаты для крупномасштабного картирования, то нам следует использовать хромосомы в более вытянутом виде. Добиться этого можно двумя способами. Механически вытянутые хромосомы могут быть получены за счёт изменения метода приготовления препарата, применяемого для выделения хромосом из метафазных ядер. Неметафазные хромосомы используются, потому что во всех стадиях клеточного цикла, кроме метафазы, хромосомы пребывают в естественном для них 37 развёрнутом состоянии. Интерфазные хромосомы
 Картирование с помощью меченых участков последовательности (STS) В настоящее время это самый мощный метод физического картирования. Меченый участок последовательности, или STS – короткая последовательность ДНК, 100 -500 п. н. в длину, которая легко опознаётся и лишь единожды встречается в хромосоме или изучаемом геноме. Чтобы нанести на карту набор STS, необходимо располагать множеством перекрывающихся фрагментов ДНК из отдельной хромосомы или полного генома. Какие фрагменты содержат какие STS, определяется методом гибридизационного анализа, или, чаще, ПЦР. Любая уникальная последовательность ДНК может быть использована в качестве STS. Для этого последовательность ДНК должна быть известна, а STS должен иметь уникальное 38 местоположение на изучаемой хромосоме.
Картирование с помощью меченых участков последовательности (STS) В настоящее время это самый мощный метод физического картирования. Меченый участок последовательности, или STS – короткая последовательность ДНК, 100 -500 п. н. в длину, которая легко опознаётся и лишь единожды встречается в хромосоме или изучаемом геноме. Чтобы нанести на карту набор STS, необходимо располагать множеством перекрывающихся фрагментов ДНК из отдельной хромосомы или полного генома. Какие фрагменты содержат какие STS, определяется методом гибридизационного анализа, или, чаще, ПЦР. Любая уникальная последовательность ДНК может быть использована в качестве STS. Для этого последовательность ДНК должна быть известна, а STS должен иметь уникальное 38 местоположение на изучаемой хромосоме.
 Методы получения STS 1. 2. 3. Ярлыки экспрессируемых последовательностей – короткие последовательности, получаемые анализом клонов к. ДНК. Полиморфизмы длины простой последовательности (SSLP) Случайные геномные последовательности – получают секвенированием случайных частей клонированной геномной к. ДНК. 39
Методы получения STS 1. 2. 3. Ярлыки экспрессируемых последовательностей – короткие последовательности, получаемые анализом клонов к. ДНК. Полиморфизмы длины простой последовательности (SSLP) Случайные геномные последовательности – получают секвенированием случайных частей клонированной геномной к. ДНК. 39
 Фрагменты ДНК для картирования с помощью STS Иначе реактив для картирования; существуют в виде библиотеки клонов и радиационных гибридов. Радиационный гибрид – клетка грызуна, содержащая фрагменты хромосом другого организма. При разбиении хромосомы на фрагменты большая доза излучения давала большее число фрагментов. Слияние стимулируется химически (полиэтиленгликолем) или биологически – вирусом Сёндай. 40
Фрагменты ДНК для картирования с помощью STS Иначе реактив для картирования; существуют в виде библиотеки клонов и радиационных гибридов. Радиационный гибрид – клетка грызуна, содержащая фрагменты хромосом другого организма. При разбиении хромосомы на фрагменты большая доза излучения давала большее число фрагментов. Слияние стимулируется химически (полиэтиленгликолем) или биологически – вирусом Сёндай. 40
 Выводы p p p Карты геномов – опорная схема для проектов секвенирования, так как они позволяют проверять точность собранной последовательности ДНК. Генетические карты строят по результатам экспериментов по скрещиванию и анализа родословных, физические карты – посредством прямого наблюдения молекул ДНК. В самых первых генетических картах маркёрами выступали гены, аллели которых можно было легко отличать (по резко отличным фенотипам), ныне же ДНК-маркёрами являются полиморфизмы длины фрагмента рестрикции (RFLP), полиморфизмы длины простой последовательности (SSLP) и полиморфизмы отдельных нуклеотидов (SNP). Все они легко типизируются посредством ПЦР. Анализ сцепления генетических признаков позволяет определить частоту рекомбинации между парой маркёров. Для многих организмов анализ сцепления генетических признаков прослеживается при помощи запланированных 41 экспериментов по скрещиванию. С людьми их проведение
Выводы p p p Карты геномов – опорная схема для проектов секвенирования, так как они позволяют проверять точность собранной последовательности ДНК. Генетические карты строят по результатам экспериментов по скрещиванию и анализа родословных, физические карты – посредством прямого наблюдения молекул ДНК. В самых первых генетических картах маркёрами выступали гены, аллели которых можно было легко отличать (по резко отличным фенотипам), ныне же ДНК-маркёрами являются полиморфизмы длины фрагмента рестрикции (RFLP), полиморфизмы длины простой последовательности (SSLP) и полиморфизмы отдельных нуклеотидов (SNP). Все они легко типизируются посредством ПЦР. Анализ сцепления генетических признаков позволяет определить частоту рекомбинации между парой маркёров. Для многих организмов анализ сцепления генетических признаков прослеживается при помощи запланированных 41 экспериментов по скрещиванию. С людьми их проведение
 Выводы p p p Генетическое картирование генома человека опирается на сведения, почёрпнутые из анализа родословной. Низкое разрешение генетических карт уточняется физическим картированием. В молекуле ДНК позиции участков рестрикции определяются рестрикционным картированием. Флюоресцентная гибридизация более продуктивная, в ней препарат зондируется маркёром, меченным флюоресцентной меткой. Позиция гибридизации определяется микроскопированием. Наиболее подробные физические карты получаются методом картирования содержания меченых участков последовательности (STS). Позиция маркёра на карте определяется фрагментами из коллекции, содержащими копии маркёра. 42
Выводы p p p Генетическое картирование генома человека опирается на сведения, почёрпнутые из анализа родословной. Низкое разрешение генетических карт уточняется физическим картированием. В молекуле ДНК позиции участков рестрикции определяются рестрикционным картированием. Флюоресцентная гибридизация более продуктивная, в ней препарат зондируется маркёром, меченным флюоресцентной меткой. Позиция гибридизации определяется микроскопированием. Наиболее подробные физические карты получаются методом картирования содержания меченых участков последовательности (STS). Позиция маркёра на карте определяется фрагментами из коллекции, содержащими копии маркёра. 42